Kimia
Organik adalah percabangan studi ilmiah dan
ilmu kimia mengenai struktur, sifat, komposisi reaksi, dan sintesis senyawa
organik. Senyawa organik terdiri oleh karbon dan hidrogen, sehingga saat ini
senyawa organik didefinisikan sebagai Kimia Senyawa Karbon.
Reaksi
Organik adalah berbagai jenis kimia yang
melibatkan senyawa organik. Berbagai jenis reaksi organik yaitu reaksi adisi,
reaksi eliminasi, reaksi substitusi, reaksi persiklik, reaksi penataan ulang,
reaksi fotokimia, dan reaksi redoks.
Reaksi
Substitusi adalah mengganti satu gugus atom atau
molekul dengan atom atau molekul yang lain. Reaksi substitusi biasanya terjadi
pada senyawa jenuh (alkana). Reaksi substitusi ini dapat juga diartikan sebagai
reaksi dimana berlangsung penggantian ikatan kovalen pada suatu atom karbon.
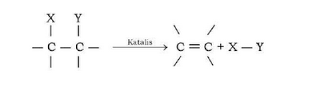
Reaksi secara umum :
Dalam
reaksi substitusi alkil halida, halida itu disebut gugus pergi (leaving group) suatu istilah yang
berarti gugus apa saja yang dapat digeser dari ikatannya dengan suatu atom karbon.
Spesi yang menyerah suatu alkil halida dalam suatu reaksi suatu substitusi
disebut nukleofil, yang sering dilambangkan dengan Nu-. Nukleofil
ialah suatu spesi apa saja yang tertarik ke suatu pusat positif.
Mekanisme reaksi adalah tahap demi tahap secara spesifik apa yang terjadi selama reaksi,
terdiri atas persamaan, struktur, dan tahap reaksi.
CH4 + Cl - Cl -> CH3 - Cl + H – Cl
Alkana Alkil Halida
Reaksi SN2
Mekanisme reaksi substitusi nukleofilik terdiri
dari dua reaksi, dan untuk kali ini akan dijelaskan mengenai reaksi SN2.
Mekanisme SN2 adalah reaksi satu tahap. Mekanisme reaksi SN2
terjadi pada alkil halida primer dan alkil halida sekunder, tetapi tidak
terjadi pada alkil halida tersier. Alkil halida primer bereaksi dengan
nukleofil yang agak kuat seperti OH, CN, CH3O. Alkil halida primer
juga bereaksi dengan nukleofil lemah, seperti H2O, tetapi reaksi ini
terlalu lambat sehingga reaksi nya tidak bermanfaat.
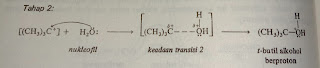
Dalam
reaksi SN2 antara bromoetana dan ion hidroksida, oksigen dari ion
hidroksida menabrak bagian belakang karbon ujung dan menggantikan ion bromide.
Berikut
ini reaksi SN2 secara keseluruhannya yaitu :
Jika
sebuah nukleofil menabrak sisi belakang suatu atom karbon tetrahedral yang terikat
pada sebuah halogen akan ada dua peristiwa terjadi sekaligus yaitu :
1.
Suatu ikatan baru mulai terbentuk
2.
Ikatan C - Br mulai patah
Proses yang terjadi ini dapat dinamakan
proses setahap atau proses serempak. Jika energi potensial kedua spesi yang
bertabrakan cukup tinggi, akan tercapai suatu titik dimana dapat dilihat dari
segi energi, pembentukan ikatan baru dan pematahan ikatan C - Br lama
dimudahkan. Ketika peraksi tersebut diubah menjadi sebuah produk, mereka harus
melewati suatu keadaan-antara yang memiliki energi potensial tinggi
dibandingkan dengan energi bereaksi atau produk. Keadaan-antara ini disebut
keadaan transisi (transition state) atau kompleks teraktifkan (activated complex).
Karena keadaan transisi melibatkan dua partikel yaitu Nu- dan RX), maka reaksi SN2
dikatakan bersifat bimolekular (bimolecular, angka 2 dalam SN2 menyatakan
bimolekular).
Reaksi
SN2 memiliki ciri ciri yaitu :
1.
Karena nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi,
maka kecepatan reaksi tergantung pada konsentrasi kedua spesies tersebut.
2.
Reaksi terjadi dengan pembalikan (inversi) konfigurasi.
3.
Jika substrat R-L bereaksi melalui mekanisme SN2, reaksi terjadi
lebih cepat apabila R merupakan gugus metil atau primer.
Permasalahan
1.
Berdasarkan artikel diatas tolong jelaskan mengapa alkil halida tersier tidak dapat
bereaksi dengan reaksi SN2 dan dikatakan reaksi yang terjadi lambat
?
2.
Kebanyakan tabrakan antar molekul itu tidak mengakibatkan suatu reaksi, dan molekul-molekul
itu hanya terpental kembali, lalu bagaimana caranya agar dapat bereaksi? Tolong
jelaskan.
3.
Pada mekanisme reaksi SN2, pereaksi akan melewati suatu keadaan-antara
yang disebut keadaan transisi. Dikatakan bahwa suatu keadaan transisi tidak
dapat diisolasi dan disimpan di botol. Mengapa demikian? Tolong jelaskan.